
代谢功能障碍相关脂肪性肝病(Metabolic Dysfunction-Associated Steatotic Liver Disease,MASLD)是全球最常见的慢性肝病,涵盖了从代谢功能障碍相关脂肪肝(MASL,即单纯性肝脂肪堆积)到代谢功能障碍相关脂肪性肝炎(Metabolic Dysfunction-Associated Steatohepatitis,MASH)在内的整个疾病谱。其中,MASH以肝细胞损伤、炎症反应及不同程度的纤维化为特征,是疾病进展的关键阶段,并可进一步发展为肝硬化甚至肝细胞癌。
MASLD病理过程十分复杂,涉及肝实质细胞与多类非实质细胞之间的一系列代谢—免疫互作网络,目前临床上仍缺乏针对性的有效治疗手段。尽管单细胞组学等前沿技术为理解 MASLD 的细胞异质性提供了重要线索,但对于人类肝组织在真实空间结构中细胞分布、代谢状态以及细胞间相互作用的系统性研究仍明显不足。

2025年11月24日,北京大学生物医学前沿创新中心/北大-清华生命科学联合中心白凡教授联合陆军军医大学第一附属医院(西南医院)柴进教授、温州医科大学附属第一医院郑明华教授以及耶鲁大学医学院欧阳新收教授在Nature Genetics在线发表题为Spatially resolved multi-omics of human metabolic dysfunction-associated steatotic liver disease的研究论文。研究团队对来自健康对照、MASL与MASH患者的61例肝脏样本进行单细胞、空间转录组和空间代谢组多模态联合分析,构建了目前规模最大的人类MASLD肝脏空间多组学图谱(https://db.genomics.cn/stomics/hmsma/),系统揭示了MASLD进程中细胞组成、基因表达及代谢状态的空间变化模式(图1)。
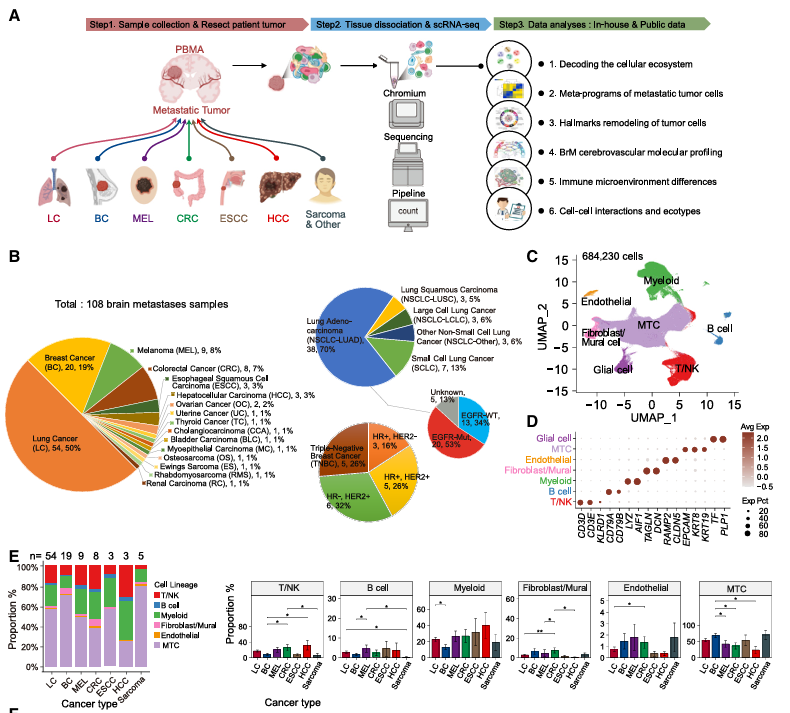
图1:人类MASLD疾病队列收集和空间多组学图谱构建
此前,已有多项研究揭示随MASLD进展,肝脏驻留库普弗细胞(Kupffer cells,KCs)自我更新能力受损,并逐步被单核衍生巨噬细胞亚群取代。在脂质堆积和纤维化区域,单核细胞来源的脂质相关巨噬细胞(lipid-associated macrophages,LAMs)特异性富集,并表现出显著的脂质摄取和代谢能力。该研究通过构建细胞类型特异基因调控网络(gene regulatory network,GRN),首次鉴定出微小眼相关转录因子(microphthalmia-associated transcription factor,MITF)是驱动LAMs脂质代谢表型的核心转录因子(图2)。
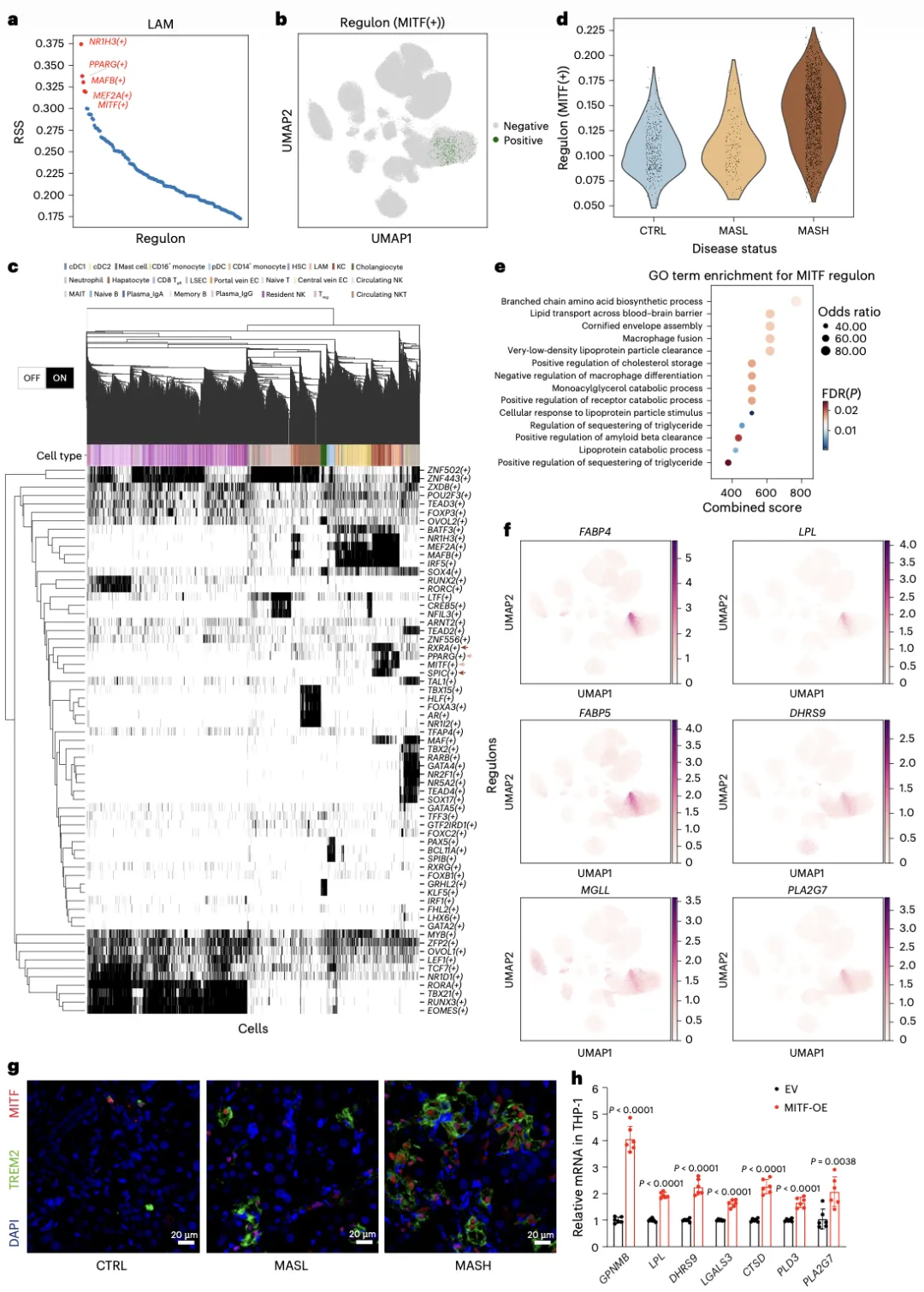
图2:MITF是调控LAMs脂质处理功能的关键调控因子
借助细胞间信号流动差异分析,研究发现LAMs是MASH阶段显著增强的肝细胞生长因子(hepatocyte growth factor,HGF)信号的重要来源。体外实验证实,LAMs条件性培养基可显著促进肝细胞增殖并抑制脂毒性凋亡,表明LAMs可通过HGF–MET信号促进肝细胞修复与存活,构成MASLD进展中由巨噬细胞介导的关键肝保护机制。这一结果揭示LAMs不仅具有脂质清除功能,还具备促进组织修复的旁分泌作用,重新定义其在MASLD病理中的角色(图3)。
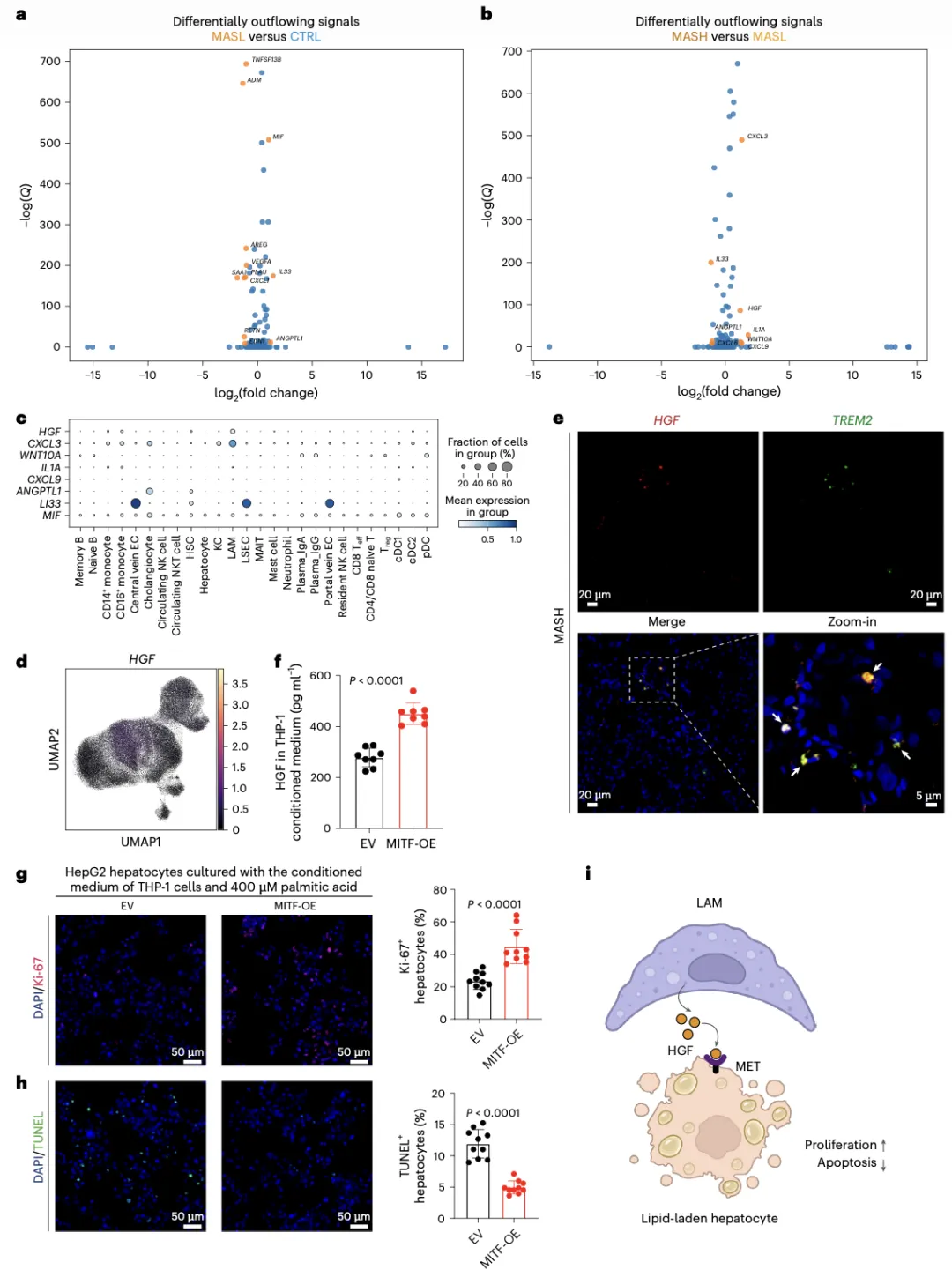
图3:LAMs通过HGF–MET信号轴发挥肝细胞保护作用
通过对空间转录组数据进行主题建模,研究鉴定出一个以COL1A1、COL1A2、LOXL1、LUM、MFAP4等典型纤维化相关基因为特征的细胞外基质重塑空间基因模块,在处于F3–4阶段(重度纤维化)的MASH患者中高度活跃。空间映射结果显示,该模块的活性分布与肝星状细胞(Hepatic stellate cells,HSCs)及中央静脉内皮细胞高度一致。进一步配体–受体互作分析揭示,中央静脉内皮细胞分泌的RSPO3与HSCs表达的受体LGR6之间存在潜在的促纤维化信号联系,提示两者间的细胞通讯可能是MASLD相关纤维化形成过程中的重要驱动因素,为解析肝纤维化微环境和开发抗纤维化治疗靶点提供了新的生物学线索。(图4)。
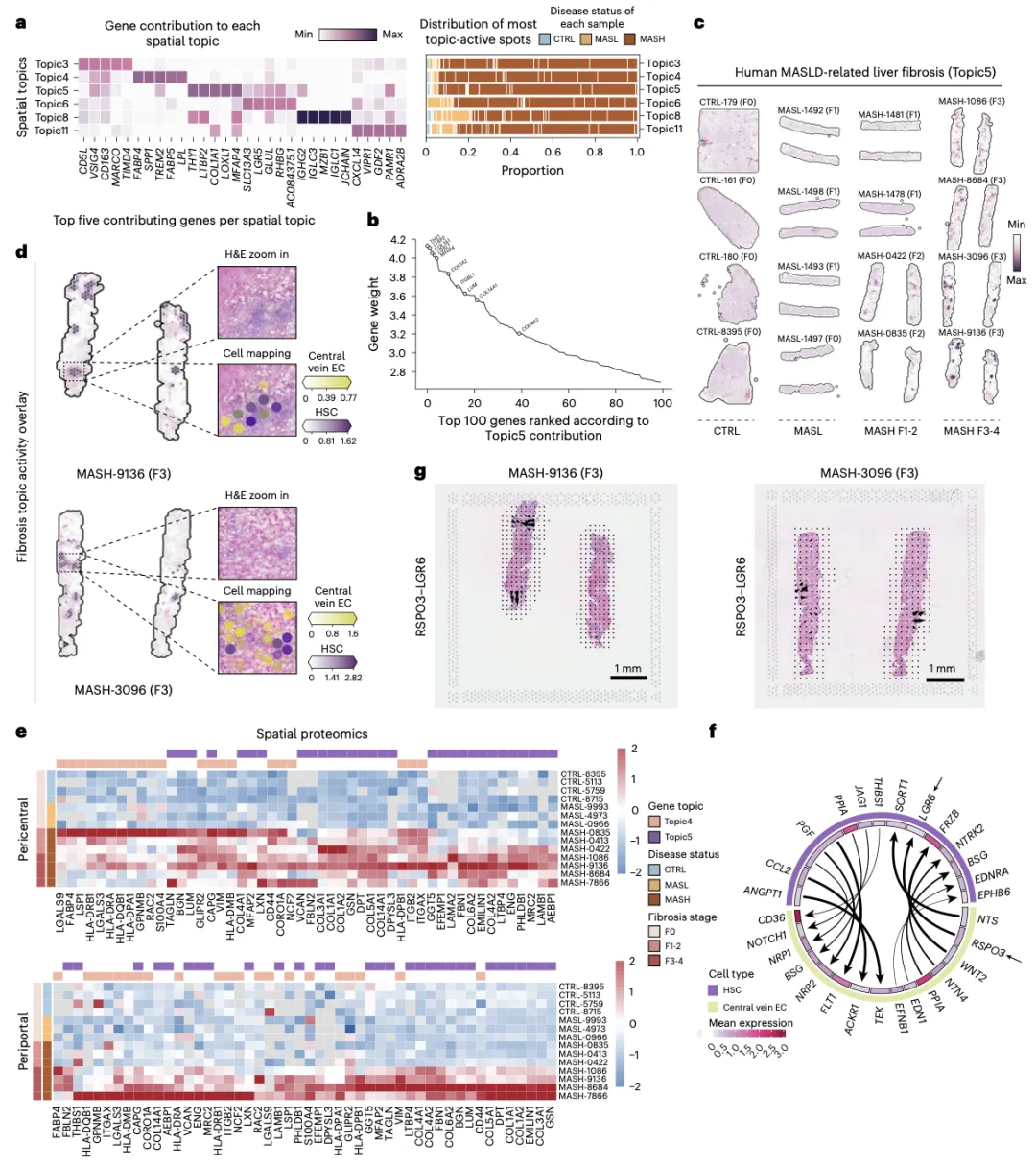
图4:MASH相关纤维化特异空间基因表达模块与细胞互作机制
空间代谢组分析显示,MASLD患者肝组织中显著积聚含超长链脂肪酸的磷脂分子,且其富集程度随疾病进展而加重。与空间转录组图像对齐后可见,该磷脂异常代谢区域与LAMs的空间富集区域高度重叠,提示LAMs与病变区域的磷脂代谢重塑密切相关。进一步分析发现,编码脂蛋白相关磷脂酶A2(Lp-PLA2)的PLA2G7在MASLD中特异表达于LAMs,并可在氧化磷脂刺激下上调。既往研究显示,氧化磷脂在肝内的积聚可诱导KCs发生铁死亡并促进纤维化,而Lp-PLA2有助于降低脂质过氧化和抑制铁死亡。基于此,研究推断LAMs在MITF调控下通过上调 PLA2G7获得对铁死亡的内在抵抗能力,从而在MASLD病理微环境中发挥稳定的代谢调节作用(图5)。
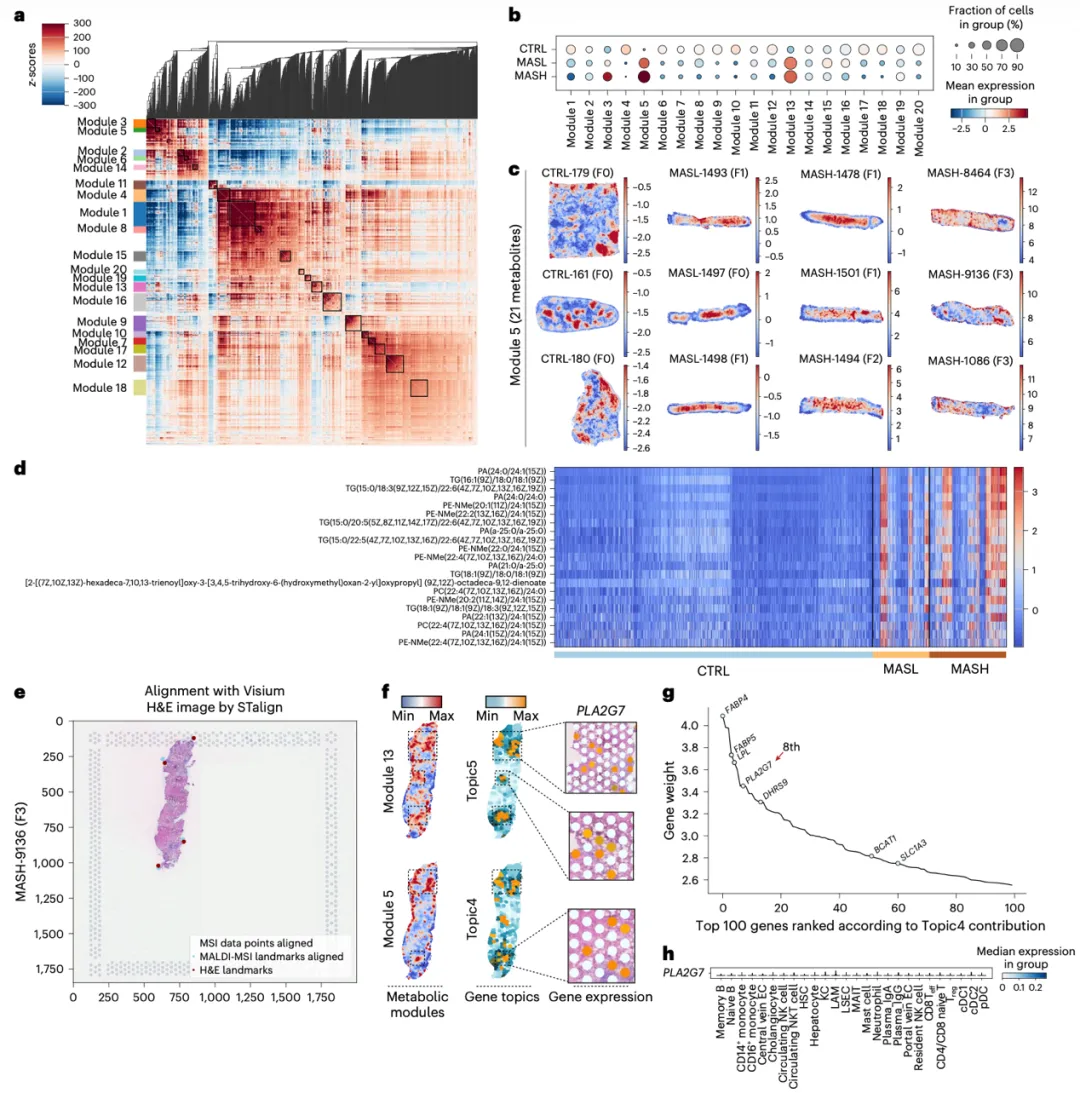
图5:空间代谢组揭示MASLD特异磷脂积累与代谢重塑
综上,本研究基于单细胞、空间转录组与空间代谢组的多模态整合分析,首次在空间维度系统描绘了MASLD患者肝脏中细胞组成、基因调控网络与代谢通路的重塑规律。机制层面,研究明确了MITF是驱动LAMs脂质代谢表型的核心转录因子,并揭示了LAMs通过HGF–MET信号轴介导的肝细胞保护效应,拓展了对这一疾病关键巨噬细胞亚群的功能认知。该研究为深入理解MASLD的病理演进机制、识别关键干预靶点及开发精准治疗策略提供了重要的理论基础与数据资源。
北京大学生命科学学院/生物医学前沿创新中心博士研究生李子煜、西南医院罗刚博士、甘昌培博士、张画羽博士和李玲硕士为该论文共同第一作者。西南医院柴进教授、北京大学白凡教授、温州医科大学郑明华教授和耶鲁大学欧阳新收教授为该论文共同通讯作者。研究获得了国家自然科学基金、国家重点研发计划、重庆市高校创新研究团队、北京市自然科学基金、科学探索奖等资助。
论文链接:
https://www.nature.com/articles/s41588-025-02407-8

白凡,北京大学生物医学前沿创新中心副主任、教授,北京大学京津冀生物医学前沿创新中心主任,北京未来基因诊断高精尖创新中心研究员,北大-清华生命科学联合中心研究员,国家优秀青年科学基金获得者,国家杰出青年科学基金获得者。2003年本科毕业于北京大学物理系,2008年获得英国牛津大学生物物理博士学位,2008-2011年间先后在牛津大学、日本大阪大学从事博士后研究工作。
白凡实验室将综合利用单分子荧光显微成像技术、单细胞基因测序技术,研究与医学临床直接相关的前沿课题,包括:(1)单细胞基因测序技术应用于癌症病人外周血循环肿瘤细胞研究,探索癌症转移的分子生物学机制及无创癌症诊断、预后判断、疗效评价的临床方法;(2)大样本基因测序研究中国人群高发癌症的基因突变特征,发掘引起癌症表型转化、转移的关键驱动事件;(3)研究细菌行为、致病性,抗生素杀菌原理和细菌抗药、耐药的分子机制。

