
持留菌(Persisters) 是细菌群体中因休眠而耐受抗生素的小亚群,可逃逸宿主免疫清除,导致感染复发与慢性迁延。持留菌的核心特征在于其独特的生存策略:它们通过进入深度休眠状态显著降低代谢活性,从而逃避抗生素的杀伤;当环境压力解除后,这类休眠细胞能动态复苏并恢复生长,成为感染复发的潜在源头;临床上,持留菌至少与20%的慢性感染密切相关,对疾病迁延与治疗失败构成持续性威胁。
2018年,北京大学生物医学前沿创新中心(BIOPIC)白凡课题组在Molecular Cell首次报道细菌中存在的一种可动态聚集和分散的新型细胞内结构—蛋白质沉淀聚集体(aggresomes)。该研究发现了aggresomes的形成和解聚在调控持留菌形成以及复苏过程中的关键作用。白凡课题组与合作者在后续研究中进一步证明aggresomes是通过液-液相分离机制形成的无膜细胞器(Science Advances, 2021),揭示了aggresomes在细菌被宿主细胞吞噬后介导细菌进入休眠状态逃逸抗生素攻击(iMeta, 2025)。然而,关于aggresomes的形成与细胞内mRNA的动态转录/翻译之间的关系还缺乏深入研究。
2025年8月19日,北京大学白凡课题组与武汉大学普颖颖课题组、英国约克大学Mark C. Leake课题组合作在微生物学研究著名期刊Nature Microbiology发表题为Aggresomes protect mRNA under stress in Escherichia coli的最新研究。该工作首次揭示了大肠杆菌蛋白质沉淀聚集体(aggresomes)扮演原核细胞内应激颗粒(stress granule)的角色——通过静电排斥机制选择性保护mRNA的完整性,从而增强细菌在逆境中的生存力与复苏效率。这一发现不仅深化了对细菌耐药机制的理解,也为靶向持留菌的新型抗菌策略提供了理论突破口。

研究团队通过高分辨率分离技术与转录组分析首次在aggresomes内检测到RNA存在,揭示了三个关键现象:(1)长链mRNA优先被招募至aggresomes;(2)与细胞质中普遍降解的RNA相比,aggresomes内部的mRNA完整性得到显著保护;(3)当环境压力解除后,这些受保护的mRNA能够迅速翻译成蛋白质,直接驱动细菌复苏过程。
关键实验证据首先来自聚合物理模型(基于FH理论)的模拟结果,表明长mRNA因更强的焓增益效应被优先招募,随着应激时间延长,aggresome逐渐压缩结构并开始招募较短转录本,最终形成高密度凝聚体。体内功能验证进一步证实,清除aggresome内的mRNA会显著延迟细菌复苏,凸显了该保护机制的必要性。
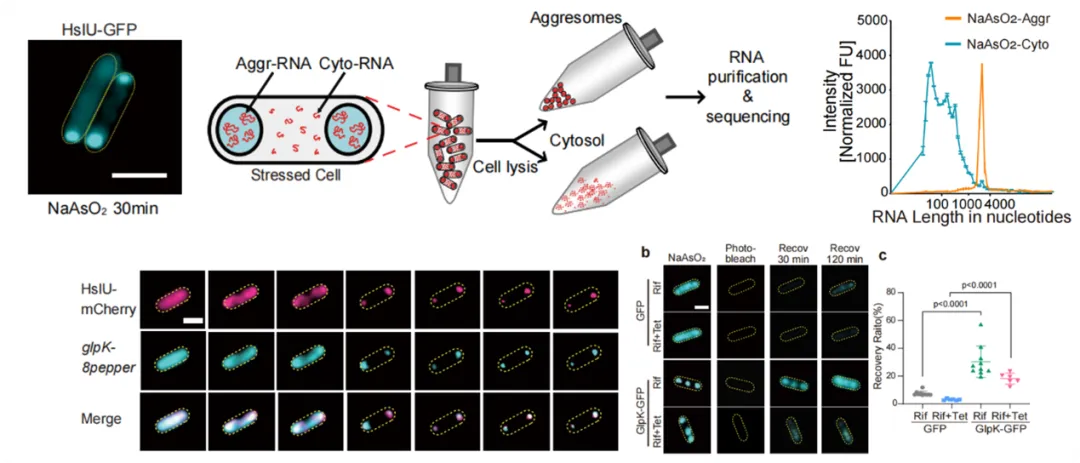
在机制层面,质谱分析发现带负电的核糖核酸酶被严格排除在aggresome外部而富集于细胞质中,这种表面电荷排斥效应通过电荷反转实验得到验证——当突变RNase使其表面电荷转为正值后,这些酶便能侵入aggresome并降解内部mRNA,导致细菌复苏能力完全丧失;而仅突变电荷但破坏酶活性的对照组中,mRNA仍受到有效保护。这一静电屏障机制使aggresome与新月柄杆菌的BR bodies形成本质区别:后者通过主动招募RNase E来平衡mRNA存储与降解,而aggresome则通过纯粹的静电排斥实现mRNA保护,体现了功能机制的进化分异。
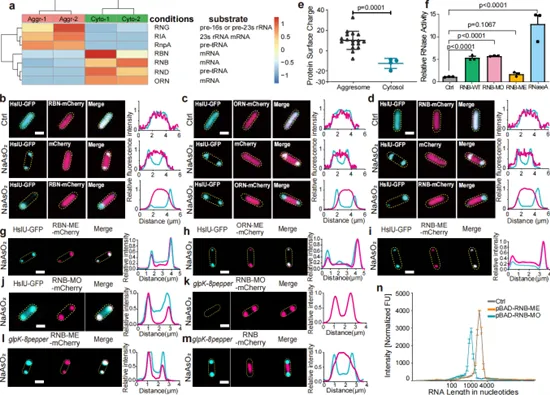
本研究首次确立aggresomes为细菌细胞内的应激颗粒,具有理论创新意义;提出“mRNA静电盾牌”模型,突破传统认知中相分离凝聚体必然混合酶-底物的局限;同时也具有应用潜力,aggresome-RNase电荷互作界面的发现,为设计破坏持留菌复苏的小分子药物提供新靶点;揭示细菌通过“休眠期存信息、复苏期速执行”策略提升环境适应力,为理解微生物进化提供新视角。
本研究由北京大学、武汉大学和英国约克大学的跨学科团队共同完成。北京大学BIOPIC白凡教授、武汉大学医学研究院普颖颖教授、英国约克大学Mark C. Leake教授为本论文的共同通讯作者。关键技术支撑来自武汉大学医学研究院/免疫与代谢前沿科学中心仪器平台和北京大学凤凰质谱平台。本项工作获得国家自然科学基金委、国家重点研发计划、湖北省自然科学基金以及武汉大学口腔医院的共同资助。
论文链接:
https://www.nature.com/articles/s41564-025-02086-5

白凡,北京大学生物医学前沿创新中心副主任、教授,北京未来基因诊断高精尖创新中心研究员,北大-清华生命科学联合中心研究员,国家优秀青年科学基金获得者,国家杰出青年科学基金获得者。2003年本科毕业于北京大学物理系,2008年获得英国牛津大学生物物理博士学位,2008-2011年间先后在牛津大学、日本大阪大学从事博士后研究工作。
白凡实验室将综合利用单分子荧光显微成像技术、单细胞基因测序技术,研究与医学临床直接相关的前沿课题,包括:(1)单细胞基因测序技术应用于癌症病人外周血循环肿瘤细胞研究,探索癌症转移的分子生物学机制及无创癌症诊断、预后判断、疗效评价的临床方法;(2)大样本基因测序研究中国人群高发癌症的基因突变特征,发掘引起癌症表型转化、转移的关键驱动事件;(3)研究细菌行为、致病性,抗生素杀菌原理和细菌抗药、耐药的分子机制。

