
CD163 是一种I型跨膜糖蛋白,主要表达于M2型单核/巨噬细胞表面,属于清道夫受体富含半胱氨酸结构域(Scavenger Receptor Cysteine-Rich, SRCR)超家族B类成员。作为重要的免疫调节受体,CD163 在维持体内稳态、调控炎症反应及清除有害分子等过程中发挥着重要作用。
在血管内外发生溶血时,红细胞释放的游离血红蛋白(hemoglobin, Hb)具有显著毒性,尤其是其所含铁离子易引发氧化损伤。 血浆中的结合珠蛋白(haptoglobin, Hp) 可迅速与 Hb 结合,形成 Hb–Hp 复合物。 CD163 作为目前已知的该复合物专一识别受体,介导Hb–Hp 复合物的内吞从而降解为胆绿素、游离铁和一氧化碳等产物,完成解毒过程。
2025年7月21日,北京大学生物医学前沿创新中心苏晓东教授团队在Nature Communications杂志发表题为Calcium-dependent oligomerization of scavenger receptor CD163 facilitates the endocytosis of ligands的研究论文,报道了CD163识别Hb–Hp复合物的三维结构,并揭示了其依赖钙离子的寡聚化机制,为理解该受体的配体识别与内吞功能提供了重要的结构基础。

论文的第一兼通讯作者徐华博士首先通过冷冻电镜技术解析了CD163识别Hb-Hp的三维复合物结构,发现HEK293细胞表达的CD163蛋白分子在复合物中形成了不同的寡聚体,分别以二聚体和三聚体形式结合配体。 进一步通过分子筛(SEC)以及分析性超速离心(AUC)分析,发现CD163的寡聚化依赖钙离子浓度调控,并且能以单体、二聚体和三聚体形式存在,随着钙离子浓度升高,三聚体的占比也随之增大。
结构分析显示,CD163通过N端的SRCR2-4结构域介导Hb-Hp复合物的识别,而C端的SRCR5-9结构域则介导其自身的寡聚化。这些过程均依赖 SRCR 结构域中富含酸性残基的钙离子结合位点(acidic cluster),通过与底物或CD163 分子中富碱性的赖氨酸区域形成稳定相互作用,实现功能性寡聚。
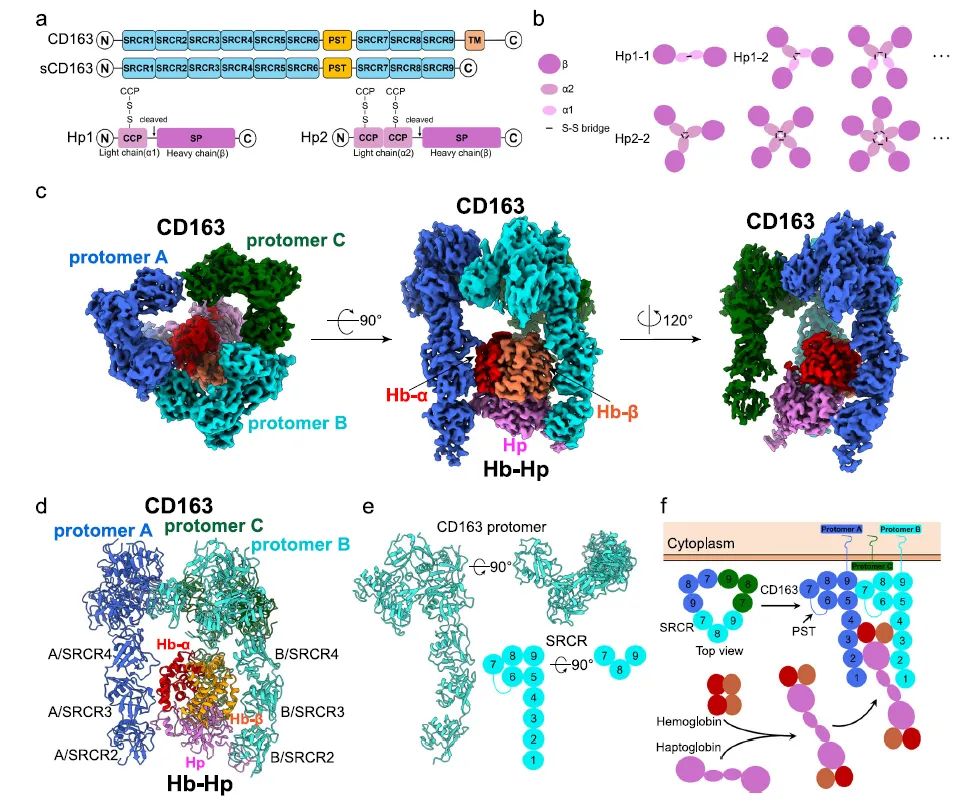
研究者们后续通过流式以及成像分析发现,当把CD163形成寡聚体的关键氨基酸突变后,CD163介导的Hb-Hp结合以及内吞效率大大降低,表明这种寡聚化机制对于CD163的生理功能有着很重要的意义。
北京大学苏晓东教授和实验室博士后徐华是本文的共同通讯作者,实验室博士后徐华和在读博士生宋晓慧是本文的共同第一作者。
论文链接:
https://www.nature.com/articles/s41467-025-62013-4

北京大学生物医学前沿创新中心常务副主任,北京大学生命科学学院教授。主要研究领域为结构生物学、生化与分子生物学、单分子生物物理、新一代基因组测序技术、抗体药物设计等。苏晓东课题组多年来,在北京大学建成高通量蛋白克隆、表达、纯化、结晶以及晶体结构解析技术平台,克隆、表达各种基因5000多种,基本实现多快好省地进行蛋白结构解析的结构基因组学研究目标;同时研发具有独立知识产权的自动化系统及相关设备,进一步提高自动化程度,降低成本。近年的研究工作包括蛋白质与DNA 相互作用,固有免疫信号传导通路及肿瘤基因组学等基础科学问题,从事与重大疾病相关的蛋白质三维结构和功能的研究,开展基于结构的药物与抗体及疫苗设计等课题,积极开展单分子生物物理学及新一代测序技术等方面的研究工作。

