
持留菌是指在抗生素作用下,细菌群体中能够耐受抗生素并存活的细胞亚群,并且在抗生素停用后能够恢复生长。因此,持留菌的存在被认为是慢性及复发性细菌感染难以根治的重要原因。研究表明,巨噬细胞吞噬细菌后能够显著提高持留菌的形成比例,这进一步凸显了体内感染治疗的挑战性。然而,关于宿主细胞内持留菌的形成机制仍缺乏深入研究。
2018年,北京大学生物医学前沿创新中心(BIOPIC)白凡课题组在Molecular Cell撰文报道大肠杆菌中存在的一种可动态聚集和分散的新型细胞内结构—蛋白质沉淀聚集体(aggresomes)。该研究发现了aggresomes的形成和解聚在调控持留菌形成以及复苏过程中的关键作用。2021年,白凡课题组与英国约克大学的Mark C. Leake课题组合作在Science Advances杂志上发表文章,进一步证明了aggresomes是通过液-液相分离机制形成的新型无膜细胞器。
沿着这一研究方向,2025年6月22日,白凡课题组在微生物学研究著名期刊iMeta上发表题为Macrophage-derived reactive oxygen species promote Salmonella aggresome formation contributing to bacterial antibiotic persistence的研究论文。该研究发现巨噬细胞中的ROS压力可以促进胞内沙门氏菌aggresomes的快速形成。形成aggresomes的细菌一方面可通过进入休眠状态逃逸抗生素攻击,同时关键性地保留了在压力环境改善后的复苏能力,从而造成感染复发。

研究人员使用鼠伤寒沙门氏菌为研究对象,选择HslU蛋白作为aggresomes的生物标记(图1A)。将细菌感染进入巨噬细胞30分钟后即可观察到aggresomes的产生(图1B,C);进一步利用小鼠感染模型,研究团队在小鼠体内的巨噬细胞中也鉴定到了形成aggresome的沙门氏菌(图1D,E)。机制探究表明,巨噬细胞来源的活性氧(ROS)是诱导细菌aggresomes形成的关键因素。通过单细胞水平ROS荧光传感器检测,研究发现产生aggresomes的细菌确实暴露于更高水平的ROS压力(图1F–H)。
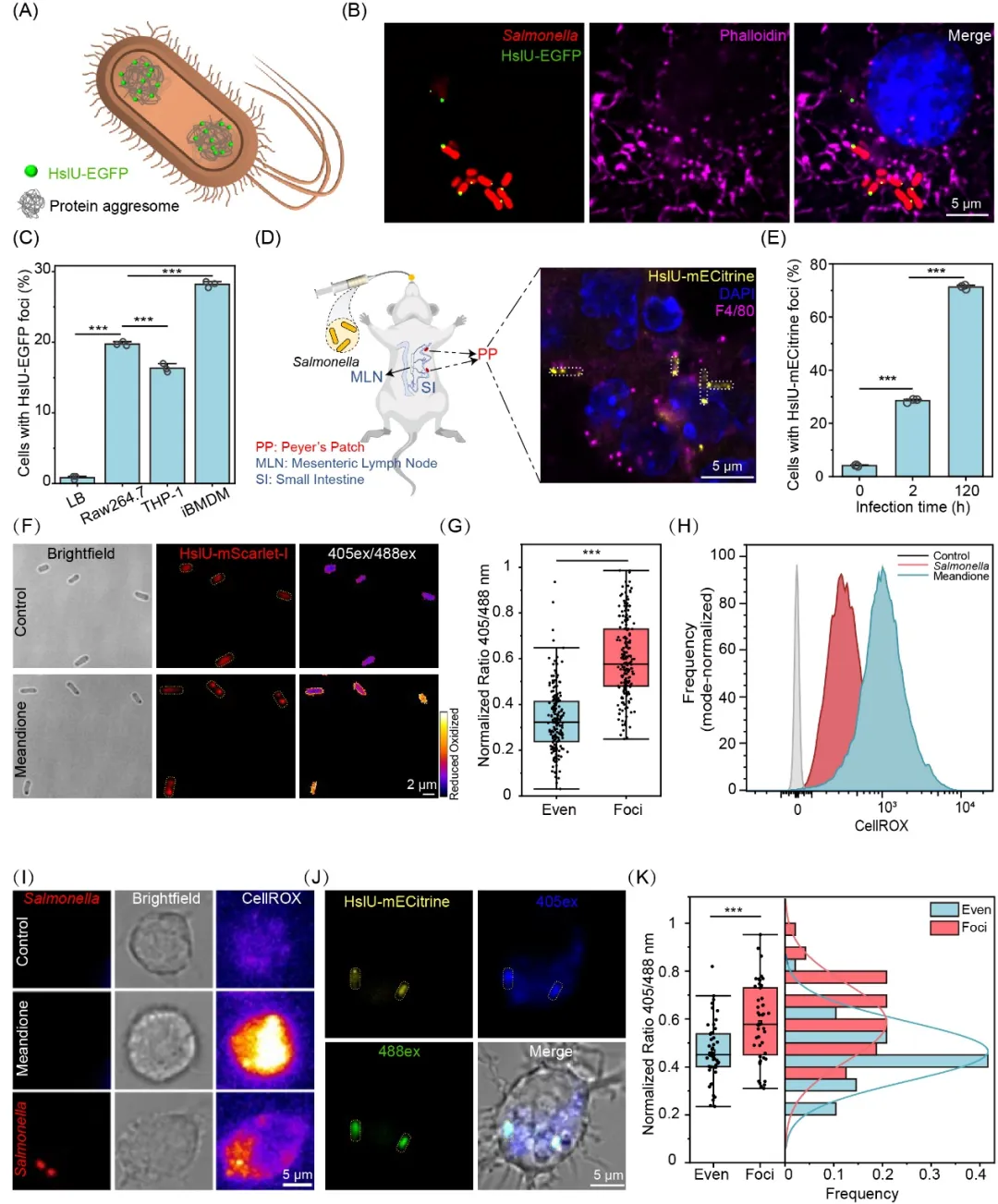
图1. 巨噬细胞内沙门氏菌aggresomes的形成
为了深入探究细菌aggresomes的生物学功能,研究人员采用单细胞荧光延时成像技术对巨噬细胞内释放出来的沙门氏菌进行了抗生素杀菌和复苏过程的动态追踪。实验结果表明,产生aggresomes的细菌贡献成为持留菌的概率相较于未产生aggresomes的细菌高8.6倍,这一发现证实了细菌aggresomes在促进持留菌形成中的关键作用(图2A–D)。
为了深入解析其分子机制,研究人员通过高分辨质谱技术鉴定了沙门氏菌aggresomes的蛋白质组成成分,并结合KEGG通路富集分析发现,沙门氏菌aggresomes中富含参与中心碳代谢、氨基酸合成、氧化磷酸化、转录和翻译等关键生物过程的必需蛋白质(图2E)。这些蛋白质的聚集可能导致细菌代谢活动的整体下调,使得细菌进入休眠状态。为了进一步验证这一点,研究人员在单细胞水平上检测了巨噬细胞内沙门氏菌的ATP水平。结果显示产生aggresomes的细菌ATP浓度相较对照组显著降低(图2F,G),为细菌通过蛋白质聚集进入休眠状态以规避抗生素杀伤的机制提供了直接证据。
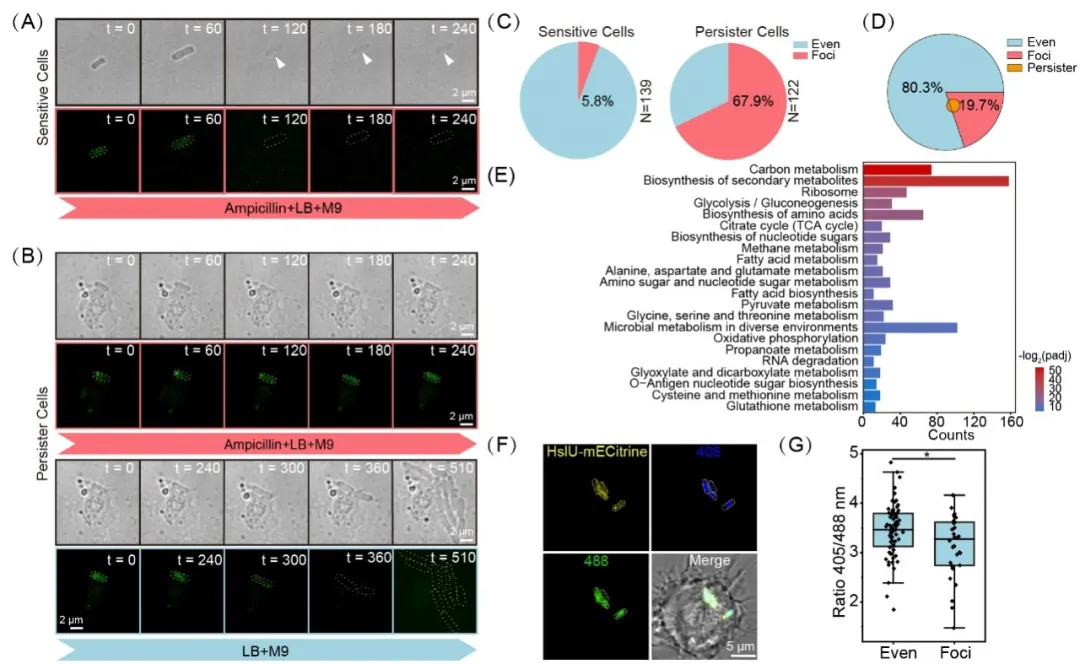
图2. 沙门氏菌aggresomes促进巨噬细胞诱导的抗生素耐药
为了进一步阐明持留菌在巨噬细胞中的复苏机制,研究人员通过沙门氏菌与巨噬细胞的双重RNA测序技术对感染过程进行了系统分析。测序结果显示,在感染早期阶段,沙门氏菌致病岛1(SPI-1)编码的III型分泌系统(T3SS)相关基因的表达显著上调。有趣的是,研究发现含有aggresomes的沙门氏菌SPI-1基因启动子活性相较于未产生aggresomes的细菌反而更高,这表明含有aggresomes的细菌仍保持着潜在的感染能力。此外,研究人员发现巨噬细胞内ROS的水平是动态变化的,感染后期巨噬细胞内的ROS水平显著降低。这一环境变化触发了沙门氏菌致病岛2(SPI-2)相关基因的表达上调以及aggresomes的解聚,最终导致细菌恢复生长和复制能力(图3)。这一发现揭示了宿主免疫压力动态变化与持留菌复苏之间的精确调控关系。
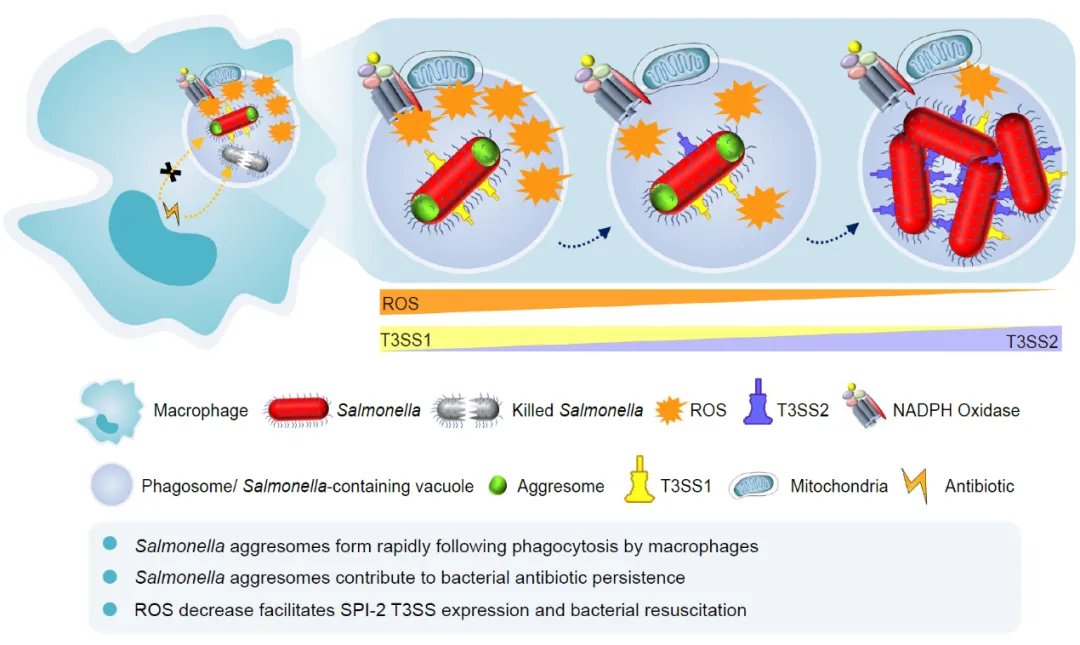
图3. 巨噬细胞内沙门氏菌aggresomes促进抗生素耐药模型
综上所述,本研究不仅揭示了持留菌造成复发性感染的关键分子事件,也为开发针对持留菌的新型治疗策略提供了重要的理论依据。针对ROS动态变化和aggresomes解聚过程的干预可能成为预防和治疗持留菌感染的新方向。
北京大学生物医学前沿创新中心、生命科学学院博士毕业生陈逍和在读博士生方可凡为本论文的并列第一作者。北京大学BIOPIC白凡教授为本论文的通讯作者。该研究得到了中国人民解放军疾病预防控制中心柯跃华副研究员、中国科学院微生物研究所王琳淇研究员、西安交通大学第二附属医院耿晶教授、英国约克大学Mark C. Leake教授的支持与帮助,得到了国家自然科学基金委、北京大学国家蛋白质科学中心、清华大学蛋白质研究技术中心的支持。
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/imt2.70059

