
脑转移(Brain metastases, BrM)是癌症晚期进展的重要标志事件,也是造成患者死亡的主要原因之一。约20%-40%的癌症患者会发生脑转移,其中肺癌、乳腺癌、黑色素瘤、结直肠癌的脑转移发病比例较高[1,2]。尽管现有治疗手段取得了一定进展[3],但因为中枢系统特殊的环境和结构,使得大多数系统性治疗药物难以发挥作用,造成脑转移的治疗难度大增[1-3]。当前,随着患者原位肿瘤有效治疗后生存时间的显著延长,脑转移的发病率大大增加,临床治疗面临严峻挑战,亟需对其进行全面系统性的研究以启迪新的治疗策略。
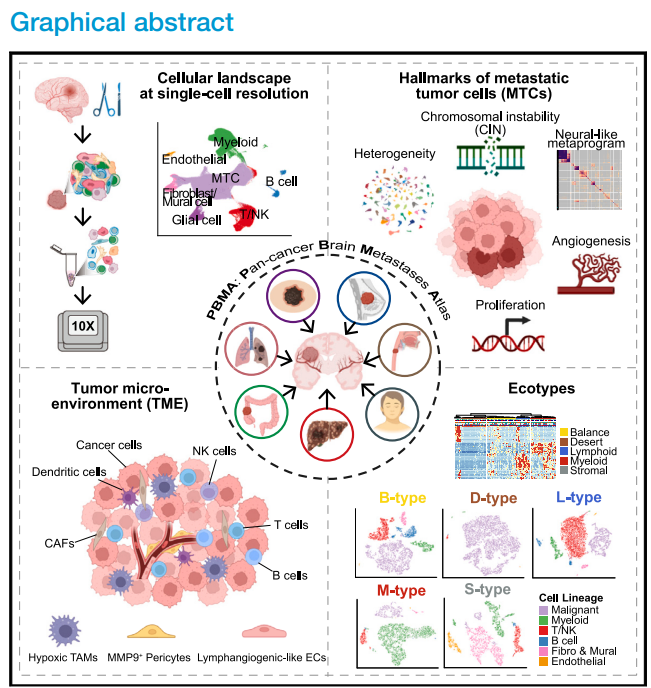
2025年4月10日,北京大学生物医学前沿创新中心(BIOPIC)白凡教授团队、中山大学附属第一医院张弩教授团队、中山大学肿瘤防治中心牟永告教授团队与美国哥伦比亚大学Benjamin Izar教授团队合作在Cancer Cell杂志在线发表了题为"Pan-cancer human brain metastases atlas at single-cell resolution"的研究论文。该研究构建了迄今为止最大规模泛癌脑转移高质量单细胞精度图谱——PBMA(Pan-cancer Brain Metastases Atlas)。鉴定了BrM跨癌种保守的特征(Hallmarks),提供了潜在可临床干预的靶标。特别地,本研究首次在脑转移领域鉴定出五种生态型(BrM-Ecotype),分别对应特定病理模式和临床特征。这些发现为攻克脑转移这一难题提供了新思路、新策略。

针对现有研究样本分散、数据高度异质的技术问题,作者通过搭建跨癌种整合分析流程,系统评估不同流程效果,成功整合了自测数据与公共数据。最终获得包含108例人类泛癌脑转移样本高质量数据集,进而刻画了BrM肿瘤微环境(Tumor microenvironment, TME)中的细胞组成类型,以及不同肿瘤类型和亚类的细胞组成比例差异(图1)。
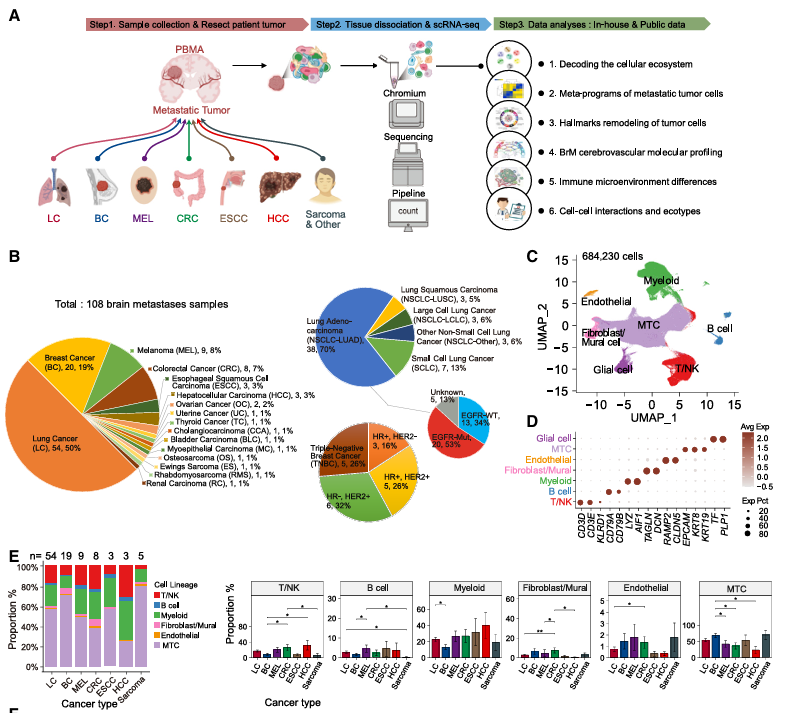
图1:研究整体流程、BrM组成细胞类型及比例差异分析
为了系统分析肿瘤脑转移进程中的重塑事件,作者对108例BrM样本和111例组织来源匹配的原发肿瘤(Primary Tumor, PT)样本进行整合对比分析。受生态和环境学中衡量物种多样性的灵感启发,作者创新性地开发了衡量肿瘤原位和转移位细胞组成成分差异程度的度量指标——重构系数(Remodeling Index,RI),全面刻画了脑转移进程中不同癌种和亚型的重构差异(图2)。
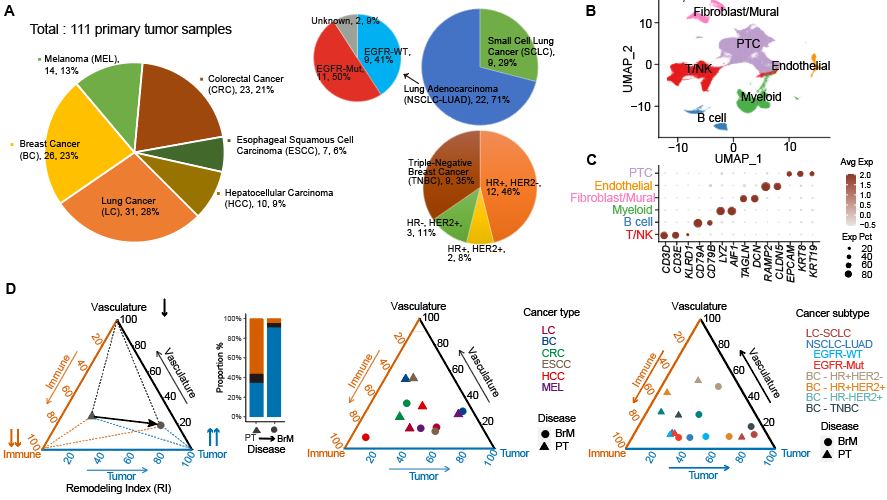
图2:利用重构系数量化脑转移进程中的重构差异
通过染色体不稳定性度量、非负矩阵分解、细胞状态打分、差异表达及通路变异分析等算法,系统鉴定了BrM恶性细胞跨癌种保守特征:包括染色体不稳定性增强、细胞增殖与血管生成特征的激活,以及神经样基因程序的激活等。有趣的是,作者发现原位肿瘤阶段,一部分细胞就具有了神经样基因程序的表达,这一结果提示在脑转移事件发生前可能就有一些恶性细胞获得了脑转移潜能。最后,作者鉴定出3个具有预测潜力的肿瘤脑转移分子靶标:PLCG2、VEGFA以及PNN(图3)。
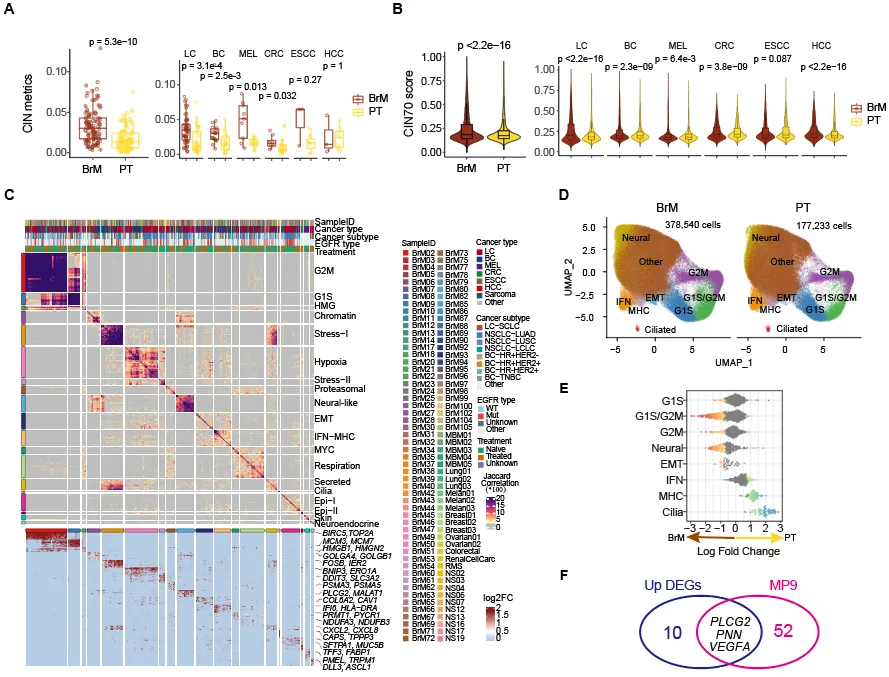
图3:肿瘤脑转移恶性细胞特征分析
通过细胞丰度差异分析,作者发现BrM-TME富集免疫抑制性细胞类型或状态,包括:缺氧型肿瘤相关巨噬细胞(Hypoxic TAMs)、MMP9+周细胞(MMP9+ Pericytes)以及一群特殊的淋巴管样血管内皮细胞(Lymphangiogenic-like ECs)。进一步作者发现这些细胞状态与BrM的不良预后及免疫治疗耐药相关(图4)。
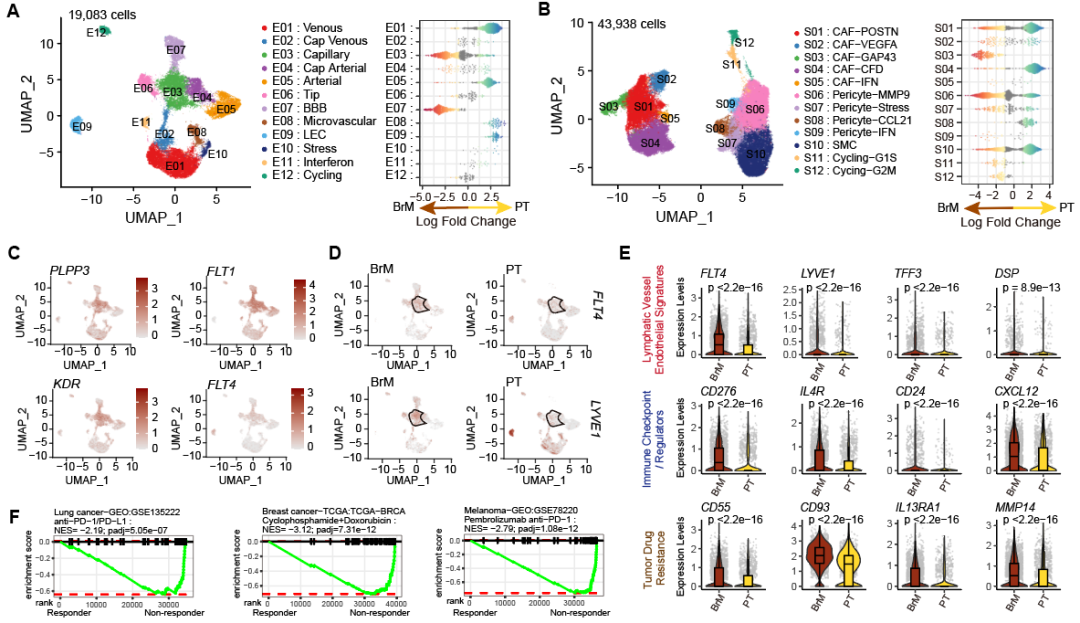
图4:BrM-TME的细胞丰度差异分析
特别地,本研究首次在脑转移中鉴定出五种生态型(BrM-Ecotype):以肿瘤细胞为主的荒漠型(D型)、淋系免疫细胞富集的L型、髓系免疫细胞富集的M型、基质细胞富集的S型,以及组成均衡的B型。作者发现不同生态型对应特定病理模式和临床特征,暗示这一分型具有指导BrM临床治疗的潜力(图5)。

图5:BrM生态型(BrM-Ecotype)分析
综上所述,本研究成功解析了肿瘤脑转移特征,并刻画了肿瘤从原发灶到脑转移进程的演化规律。该研究不仅为理解脑转移机制提供了关键资源,更鉴定出多个脑转移关键进展标志事件,提供了潜在治疗干预靶点,为改善脑转移患者临床疗效开辟了数据驱动研究的新范式。这一突破性成果有望推动肿瘤转移领域精准治疗策略的开发。
北京大学生物医学前沿创新中心(BIOPIC)白凡教授、中山大学附属第一医院张弩教授、中山大学肿瘤防治中心牟永告教授与美国哥伦比亚大学Benjamin Izar教授为本文的共同通讯作者。中国科学院北京基因组研究所(国家生物信息中心)邢旭东研究员、中山大学附属第一医院博士后钟键、博士生张鑫宇、中山大学肿瘤防治中心段昊博士、美国哥伦比亚大学Jana Biermann博士和陆军军医大学西南医院时雨教授为本文的共同第一作者。
原文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00126-6
参考文献
1. Achrol, A.S., Rennert, R.C., Anders, C., Soffietti, R., Ahluwalia, M.S., Nayak, L., Peters, S., Arvold, N.D., Harsh, G.R., Steeg, P.S., and Chang, S.D. (2019). Brain metastases. Nat Rev Dis Primers 5, 5. 10.1038/s41572-018-0055-y.
2. Boire, A., Brastianos, P.K., Garzia, L., and Valiente, M. (2020). Brain metastasis. Nat Rev Cancer 20, 4-11. 10.1038/s41568-019-0220-y.
3. Suh, J.H., Kotecha, R., Chao, S.T., Ahluwalia, M.S., Sahgal, A., and Chang, E.L. (2020). Current approaches to the management of brain metastases. Nat Rev Clin Oncol 17, 279-299. 10.1038/s41571-019-0320-3.

白凡,北京大学生物医学前沿创新中心副主任、教授,北京未来基因诊断高精尖创新中心研究员,北大-清华生命科学联合中心研究员,国家优秀青年科学基金获得者,国家杰出青年科学基金获得者。2003年本科毕业于北京大学物理系,2008年获得英国牛津大学生物物理博士学位,2008-2011年间先后在牛津大学、日本大阪大学从事博士后研究工作。
白凡实验室将综合利用单分子荧光显微成像技术、单细胞基因测序技术,研究与医学临床直接相关的前沿课题,包括:(1)单细胞基因测序技术应用于癌症病人外周血循环肿瘤细胞研究,探索癌症转移的分子生物学机制及无创癌症诊断、预后判断、疗效评价的临床方法;(2)大样本基因测序研究中国人群高发癌症的基因突变特征,发掘引起癌症表型转化、转移的关键驱动事件;(3)研究细菌行为、致病性,抗生素杀菌原理和细菌抗药、耐药的分子机制。

